2023年11月6日Cell Reports Physical Science在线发表华中科技大学武汉光电国家研究中心、高端生物医学成像重大科技基础设施张玉慧教授团队最新研究成果。该论文题为“Cytosolic delivery of cell-impermeable fluorescent probes by mixtures of cell-penetrating peptides for multicolor long-term live-cell nanoscopy”。

近年来活细胞超分辨成像技术日趋完善,使利用荧光显微镜可视化活细胞中亚细胞结构间的动态相互作用成为可能。要实现活细胞中亚细胞结构动态可视化成像不仅需要先进的超分辨荧光显微成像系统还需要高性能的荧光探针特异性标记活细胞中的各种亚细胞结构。有机小分子荧光探针相较于荧光蛋白具有荧光量子产率高、抗光漂白能力强、分子尺寸小和易于改造等诸多优势,因此是理想的活细胞超分辨成像探针。但由于细胞膜具有选择透过性,很多具有高荧光亮度和强抗漂白能力的商业化探针(如:SNAP-DY549和Halo-Alexa488等)都无法自主扩散进入活细胞,通常只能用于死细胞标记,这极大限制了可用于活细胞超分辨成像的有机小分子荧光探针的可选范围。针对上述问题张玉慧教授团队近年来发展了一系列基于肽型载体的不透膜有机小分子荧光探针活细胞递送策略。
本文中张玉慧教授团队首先对多种类型的肽型载体递送不透膜有机小分子荧光探针进入活细胞的效果进行了定性与定量评估,发现一些肽型载体具有较高的探针递送能力,但协助探针从内吞体中逃逸出来的能力较弱,另一些肽型载体的探针递送能力较差,但具有高效的内吞体逃逸能力。基于此研究结果,不同于目前常用直接改变肽型载体化学结构来优化其递送性能的策略,作者提出了一种全新构建肽型载体的多肽混合策略:通过将具有不同递送能力和逃逸能力的肽型载体按不同比例混合,建立肽型载体库,从中筛选出可以高效递送探针进入细胞并可协助探针高效释放到细胞质中的肽型载体。基于该策略,本文通过系统性筛选62种肽型混合物,获得混合型肽型载体mixLPV,成功实现了高效递送(高达97%标记效率)和几乎100%内吞/溶酶体逃逸(图1)。该研究不仅为纳米显微镜的使用奠定坚实的探针标记基础,也为设计和改进肽型载体性能开辟了一条新途径。
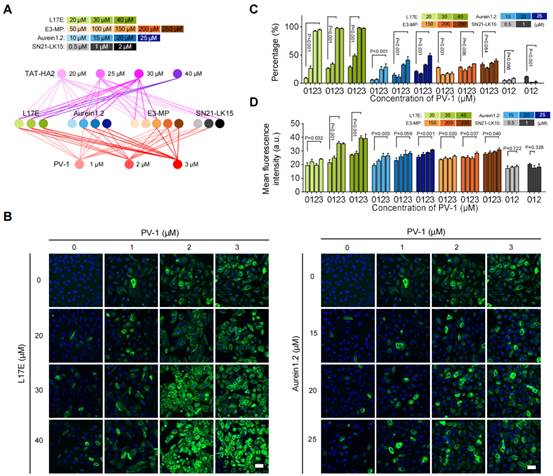
图1. 不同比例肽型载体混合物递送不透膜探针能力的定性与定量分析
进一步作者利用mixLPV递送多种具有优秀荧光性能但不透膜的有机小分子荧光探针进入活细胞实现对多种细胞器的单色或多色特异性标记(包括:内质网、中间纤维、细胞核、线粒体、微管、网格蛋白包被小泡、早期内体、晚期内体及过氧化物酶体)(图2和图3)。进而利用这些高性能有机小分子荧光探针结合结构光照明超分辨成像系统(SIM)对活细胞中多种亚细胞结构间的动态相互作用进行了长时程成像,特别是系统研究了过氧化物酶体与多种亚细胞结构(包括:微管、内质网、早期内体及晚期内体)之间的动态互作(图4),首次在哺乳动物细胞中记录到过氧化物酶体与晚期内体间的搭便车运动行为,并通过定量分析发现在哺乳动物细胞中,相较于早期内体,过氧化物酶体更倾向于和晚期内体进行搭便车运动。
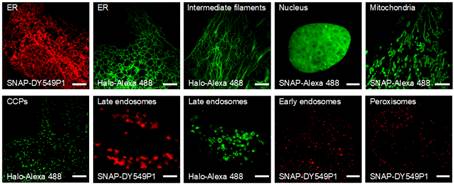
图2. mixLPV递送不透膜有机小分子荧光探针进入活细胞实现对多种细胞器特异性标记

图3. mixLPV同时递送多种不透膜有机小分子荧光探针进入活细胞实现多色成像
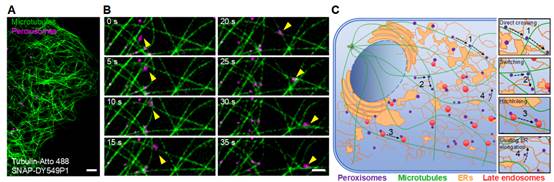
图4. 过氧化物酶体与多种亚细胞结构之间的动态互作
张玉慧教授团队长期专注于开发具有优秀荧光性能的非透膜有机小分子荧光探针活细胞递送策略,先后发展了多种肽型载体递送工具。2014年率先将细胞穿膜肽(CPPs)引入到有机荧光探针的结构中,实现了对活细胞中微丝、溶酶体等亚细胞结构的超分辨动态成像(Nature Communications 2014, 5:5573),后续提出了两段式连接方法进一步完善了上述探针递送策略(Nature Communications 2017, 8:1307)。2019年,提出了一种不透膜探针与肽型载体(PV-1)简单共孵育即可实现不透膜探针活细胞递送的探针递送策略,极大地降低了递送不透膜探针进入活细胞的难度(Light: Science & Applications, 2019, 8:73)。但上述方法存在部分探针无法从内吞体中释放出来的问题,从而在标记点状结构时存在假阳性信号。针对上述问题2023年团队进一步发展了基于mixLPV的不透膜探针活细胞递送策略,解决了探针无法高效从内吞体中释放出来的难题,进一步丰富了递送不透光探针进入活细胞的递送工具,并扩展了可用于活细胞超分辨成像的高荧光性能有机小分子荧光探针的可选范围(本文)。
该研究工作得到了国家重点研发计划、国家自然科学基金委员会面上项目、中国博士后科学基金、湖北省卫生与计划生育科学研究项目和武汉光电国家研究中心主任基金等项目的资助。华中科技大学张玉慧教授和武汉血液中心马严博士为论文通讯作者,博士后张朦与博士生张文婷为并列第一作者。
论文链接:https://www.cell.com/cell-reports-physical-science/fulltext/S2666-3864(23)00503-9